Fisika Inti , Partikel Penyusun Inti Atom , Massa Atom , Gaya , Defek Massa , Ukuran dan Bentuk , Energi Ikat , Stabilitas , Rumus , Contoh Soal , Jawaban - Salah satu materi bakar dalam stasiun pembangkit tenaga nuklir ialah uranium. Uranium merupakan salah satu unsur radioaktif yang mempunyai nomor atom tertinggi dari semua unsur atom. Energi dihasilkan ketika pada dasarnya membelah membentuk unsur-unsur lain. Selain uranium , masih banyak lagi unsur radioaktif yang sangat berkhasiat bagi kita , alasannya ialah unsur radioaktif ialah unsur yang gampang meluruh membentuk unsur lain. Nah , untuk mengetahui ihwal unsur radioaktif dan reaksi pembelahan atau peluruhannya ikuti pembahasan berikut ini.
 |
| Gambar 1. Reaktor nuklir memakai unsur radioaktivitas. [1] |
Inti atom merupakan partikel yang mempunyai massa dan bermuatan positif. Sifat-sifat utama dari atom secara keseluruhan akan memengaruhi sifat zatnya. Makara , untuk mengetahui sifat-sifat molekul suatu zat akan lebih baik jikalau kita mempelajarinya mulai dari struktur inti zat yang bersangkutan.
Struktur inti terdiri atas proton dan neutron yang disebut nukleon. Pada tahun 1911 , menurut eksperimen yang dilakukannya , Rutherford beropini bahwa muatan positif atom dikonsentrasikan di pusat atom sebagai inti atom. Kemudian , ia melaksanakan eksperimen dengan menembakkan partikel alfa pada atom yang diamati. Berdasarkan pengamatannya , partikel yang ditembakkan dihamburkan. Dari percobaan hamburan ini diambil kesimpulan mengenai distribusi muatan listrik yang ada di dalam atom sasaran. Pada dikala itu , Rutherford belum sanggup menjelaskan ihwal kestabilan inti atom sehingga gerak elektron di dalam atom belum sanggup dijelaskan. Tidak usang kemudian Niels Bohr membuatkan teori mengenai struktur atom menurut penemuanpenemuan terdahulu. Sampai kini model atom Bohr-Rutherford terus dikembangkan dalam fisika nuklir.
1. Partikel Penyusun Inti Atom
Semua atom sanggup diidentifikasi menurut jumlah proton dan neutron yang dikandungnya. Jumlah proton dalam inti setiap atom suatu unsur disebut nomor atom (Z).
Dalam suatu atom netral jumlah proton sama dengan jumlah elektron , sehingga nomor atom juga membuktikan jumlah elektron yang ada dalam atom. Nomor massa (A) ialah jumlah total neutron dan proton yang ada dalam inti atom suatu unsur. Secara umum sebuah inti atom dinotasikan: 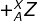
 |
| Gambar 2. Struktur inti atom. |
Jumlah neutron dalam suatu atom sama dengan selisih antara nomor massa dan nomor atom , atau A – Z. Sebuah atom mempunyai tiga komponen dasar yang sangat penting yaitu elektron , proton , dan neutron. Tabel 1. menawarkan massa dan muatan dari ketiga partikel tersebut.
Tabel 1. Massa dan muatan partikel subatom
Partikel | Massa (g) | Muatan | |
Coulomb | Satuan Massa | ||
Elektron | 9 ,10939 x 10-28 | - 1 ,6022 x 10-29 | -1 |
Proton | 1 ,67262 x 10-24 | + 1 ,6022 x 10-29 | +1 |
Neutron | 1 ,67493 x 10-24 | 0 | 0 |
1.1. Massa Atom
Massa suatu atom berafiliasi erat dengan jumlah elektron , proton , dan neutron yang dimiliki atom tersebut. Berdasarkan perjanjian internasional , satu atom dari isotop karbon (disebut karbon-12) yang mempunyai enam proton dan enam neutron mempunyai massa sempurna 12 satuan massa atom (sma). Atom karbon-12 ini digunakan sebagai standar , sehingga satu satuan massa atom didefinisikan sebagai suatu massa yang besarnya sempurna sama dengan seperduabelas massa dari satu atom karbon-12. Massa satu atom karbon-12 = 1 sma.
1 sma = massa satu atom karbon-12 / 12 = 1 ,66056 × 10-27 kg
Satuan massa atom juga sanggup dinyatakan menurut prinsip kesetaraan massa dan energi yang dikemukakan oleh Einstein. Sehingga diperoleh:
Inti sebuah massa atom hampir mengandung seluruh massanya. Hal ini alasannya ialah inti merupakan tempat terkonsentrasi seluruh massa atom (sesuai model atom Rutherford). Alat yang sanggup digunakan untuk mengukur massa atom disebut spektrometer massa , ibarat yang ditunjukkan pada Gambar 3.
 |
| Gambar 3. Skema spektrometer massa. |
Pada sebuah spektrometer massa , suatu sampel gas ditembak oleh anutan elektron berenergi tinggi. Tumbukan antara elektron dan atom (atau molekul) gas menghasilkan ion positif dengan terlepasnya satu elektron dari tiap atom atau molekul. Ion-ion tersebut hingga pada sebuah detektor , yang mencatat arus listrik dari tiap jenis ion.
Jumlah arus listrik yang dihasilkan sebanding dengan jumlah ion , sehingga sanggup ditentukan kelimpahan relatif dari isotop-isotopnya.
1.2. Defek Massa
Defek massa menawarkan selisih antara massa membisu sebuah inti atom dan jumlah seluruh massa membisu masing-masing nukleonnya dalam keadaan tak terikat. Makara , defek massa ialah kesetaraan massa energi ikat menurut persamaan massa-energi.
Isotop dengan jumlah proton Z dan jumlah neutron (A – Z ) mempunyai massa inti sebesar:
mi = Z.mp+ (A – Z ) mn ...................................... (1)
Dengan mp ialah massa proton dan mn ialah massa neutron. Berdasarkan pengukuran diperoleh hasil bahwa massa inti atom lebih kecil daripada massa nukleon. Menurut aturan kesetaraan massa dan energi , besarnya defek massa dinyatakan:
m = Z.mp + (A –Z ) mn – mi ................................. (2)
Defek massa atau susut massa timbul alasannya ialah untuk menyusun inti diharapkan energi yang mengikat semua nukleon , yang disebut energi ikat (binding energy) , yang diperoleh dari massa inti. Berdasarkan teori relativitas Einstein mengenai kesetaraan antara massa dan energi diberikan oleh:
ΔE = (Δm). c2 ......................................................... (3)
dengan c ialah kecepatan cahaya.
Derek massa Δm dinyatakan dalam sma , maka energi ikat Δe dirumuskan: ΔE = Δm (931 MeV/sma)
1.3. Ukuran dan Bentuk Inti Atom
Eksperimen hamburan Rutherford membuktikan bahwa inti mempunyai ukuran dan bentuk. Volume inti banyak sekali atom mempunyai nilai yang berbanding lurus dengan banyaknya nukleon yang dikandungnya. Hal ini berarti kerapatan nukleonnya hampir sama dalam bab dalam inti. Inti atom tidak mempunyai permukaan yang jelas. Meskipun demikian , sebuah inti atom tetap mempunyai jari-jari rata-rata. Jari-jari inti bergantung pada massa , jumlah proton , dan neutron. Jari-jari inti dirumuskan secara empiris sebagai suatu pendekatan , yaitu:
R = R0. A1/3 ...................................................... (4)
dengan:
A = nomor massa atom
R = jari-jari inti (fm)
R0 = 1 ,2 × 10-15m
Inti suatu atom telah kita anggap sebagai bola. Tetapi , pada kenyataannya beberapa inti atom mempunyai distribusi muatan tidak simetri bola. Oleh alasannya ialah volume bola berbanding lurus dengan R 3 , maka persamaan (4) menawarkan bahwa volume inti berbanding lurus dengan nomor massanya. Karena itu , untuk semua inti kecepatannya berbanding lurus dengan AR 3 , sehingga dengan pendekatan tertentu , semua inti mempunyai kerapatan yang sama , yaitu:
Kerapatan inti mempunyai nilai konstan di bab dalam inti dan nilai tersebut akan berkurang menuju nol di seluruh tempat permukaan yang kabur.
Sifat-sifat kimia karbon ditentukan oleh enam muatan negatifnya. Dalam atom karbon-12 , inti juga mempunyai enam neutron , yang massanya kira-kira sama dengan proton , menciptakan bilangan massa atom 12.
Contoh Soal 1 :
Contoh Soal 1 :
Berapakah kerapatan inti dari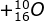 ?
?
Penyelesaian:
1.4. Energi Ikat Inti dan Stabilitas Inti Atom
Pada umumnya , inti yang mempunyai nukleon yang lebih besar mempunyai tingkat stabilitas inti yang rendah. Sehingga , tingkat stabilitas suatu inti ternyata tidak selalu ditentukan oleh besarnya energi ikat inti.
Karena itu , besarnya energi yang berafiliasi eksklusif dengan stabilitas inti ialah energi ikat per nukleon yang besarnya sanggup dihitung melalui persamaan:
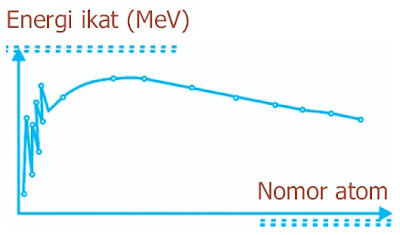 |
| Gambar 4. Energi ikat per nukleon unsur-unsur dengan nomor atom. |
En = E/A
dengan:
En = energi ikat per nukleon (MeV)
E = energi ikat inti (MeV)
A = jumlah nukleon
1.5. Gaya Inti Atom
Gaya Inti ialah gaya yang mengikat nukleonnukleon , dengan kata lain gaya antarnukleon. Gaya Inti ternyata amat berpengaruh tetapi jangkauannya amat pendek , dan tidak tergantung jenis nukleon , yaitu gaya antara proton dengan proton sama dengan gaya antara proton dengan neutron , maupun antara neutron dengan neutron. Ini berarti , bahwa gaya inti tidak bergantung pada muatan listrik nukleon (charge independent). Selanjutnya , ternyata gaya inti itu bersifat jenuh (saturated) , yaitu setiap nukleon hanya tarik-menarik dengan nukleon di sekitarnya , ibarat halnya gaya Van der Walls antarmolekul cairan. Sifat jenuh gaya inti ini diamati menurut kejenuhan tenaga ikat per nukleon yang sekitar 8 MeV untuk semua unsur yang bilangan massanya A melebihi 60 , ibarat yang diperlihatkan oleh grafik pada Gambar 11.3.
Contoh Soal 2 :
Massa assa atom 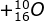 adalah 15 ,995 sma; hidrogen 1 ,0078 sma; dan neutron 1 ,0087 sma. Tentukan:
adalah 15 ,995 sma; hidrogen 1 ,0078 sma; dan neutron 1 ,0087 sma. Tentukan:
a. massa total partikel pembentuk ,
b. defek massa ,
c. energi ikat inti oksigen ,
d. energi ikat rata-rata per nukleon!
Penyelesaian:
Besaran yang diketahui:
mi = 15 ,995 sma
mp = mH = 1 ,0078 sma
mn = 1 ,0087 sma
Z = 8
A = 16
neutron = A – Z = 16 – 8 = 8
a. Massa total nukleon = massa total proton + massa total neutron
= 8 mp + 8 mn
= 8 (mp + mn)
= 8 (1 ,0078 + 1 ,0087)
= 16 ,132 sma
b. m = Z.mp + ( A – Z ) mn – mi
= 8 (1 ,0078) + (16 – 8) (1 ,0087) – 15 ,995
= 0 ,137 sma
c. E = m (931 MeV/sma)
= (0 ,137 sma) (931 ,5 MeV/sma)
= 127 ,62 MeV
d. En = E/A = 127 ,62 MeV / 16 nukleon = 7 ,97625 MeV/nukleon
2. Radioaktivitas
Anda kini sudah mengetahui Fisika Inti. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Budiyanto , J. 2009. Fisika : Untuk SMA/MA Kelas XII. Pusat Perbukuan , Departemen Pendidikan Nasional , Jakarta. p. 298.
Referensi Lainnya :
[1] http://en.wikipedia.org/wiki/File:Huy ,_koeltorens_2007-05-01_14.57.JPG
Referensi Lainnya :
[1] http://en.wikipedia.org/wiki/File:Huy ,_koeltorens_2007-05-01_14.57.JPG
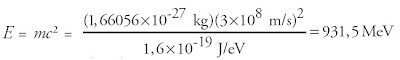

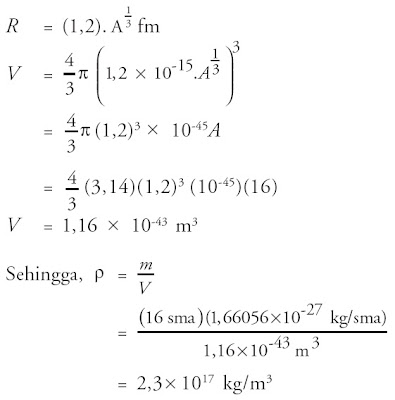
0 Response to "Fisika Inti| Partikel Penyusun Inti Atom| Massa Atom| Gaya| Defek Massa| Ukuran Dan Bentuk| Energi Ikat| Stabilitas| Rumus| Pola Soal| Jawaban"